文献解读

|文章题目: 全新设计与合成用于重新设定巨噬细胞极化的多肽免疫调节剂
| 期刊名称: BioDesign Research
| 发表时间: 2023年2月7日
| 原文链接:https://doi.org/10.34133/bdr.0006
研究背景
巨噬细胞是全身分布的免疫细胞,也是肿瘤微环境中最常见的浸润白细胞之一。巨噬细胞在癌症免疫治疗中扮演着双重角色,M1型巨噬细胞通过分泌趋化因子,具有抗肿瘤作用,而M2型巨噬细胞则促进肿瘤进展。然而,目前基于无机纳米颗粒的免疫调节剂存在生物相容性差、毒性高和剂量窗口窄等问题,限制了其应用前景。
相比之下,蛋白质和多肽基纳米材料细胞相容性好、生物降解可控和易代谢能力。然而,这种材料也面临一些问题,如免疫调节活性不足、批次间稳定性差以及可能含有异种化合物等,限制了其在免疫调节中的广泛应用。因此,为克服这些限制,开发一种具有良好生物相容性、精确免疫调节能力且适用于局部生态位的仿生纳米纤维显得尤为重要。
研究方法
1. 设计与合成:
- 通过结合丝蛋白序列、胶原蛋白中的RGD基序和层粘连蛋白中的IKVAV基序,设计出具有自组装能力的仿生多肽。
- 通过大肠杆菌表达系统合成多肽,并使用纯化和结构预测技术验证其组成与结构。
2. 自组装研究:
- 通过分子动力学模拟和原子力显微镜观测研究多肽的纳米纤维自组装过程。
3. 生物功能验证:
- 使用RAW264.7细胞进行细胞增殖和极化实验,通过qPCR和ELISA检测细胞因子水平,评估免疫调节效果。
研究结果
01 多肽的设计与结构验证
作者设计了一种融合蛋白,通过将三个功能性基序串联构建成多肽模块,形成具有特定物理性能的仿生蛋白质(BMPP)。这些基序分别是:
(1) 来源于络新妇蛛丝的序列(GGSGGPGGPASAANSASRATSNSP)n;
(2) 来自胶原蛋白的 RGD 基序;
(3) 来源于层粘连蛋白的 IKVAV基序。
这种设计结合了不同基序的特性,以满足机械性能和功能需求。仿蛛丝蛋白序列为融合蛋白提供了高拉伸强度,同时 GGX/GPGX序列产生的无定形结构域赋予纤维良好的延展性。此外,融合蛋白中加入的 RGD 和 IKVAV基序分别增强了与细胞的粘附能力以及神经再生的促进作用。
研究团队使用工程化的大肠杆菌 BL21(DE3)表达并生物合成了这些BMPP。通过 SDS-PAGE分析,验证了BMPP的高纯度,并采用 MALDI-MS 测定其分子量,发现BMPP的特征峰分别为 9.7 kDa([M + 2H]²⁺)和 19.3 kDa([M + H]⁺),对应其预期的分子量范围。
研究团队使用tFold 软件预测了BMPP单体的分子结构,结果显示BMPPs呈现由 GGSGPGGPASAANSASRATSNSP 重复单元形成的富含 α-螺旋 的构象。这种α-螺旋特性赋予了融合蛋白更高的结构稳定性和功能适配性。
为了进一步表征BMPP的二级结构,团队进行了 圆二色谱(CD)测量。结果表明,BMPP的二级结构从随机卷曲逐渐转变为 α-螺旋,这一变化体现在光谱上:198 nm处的负带逐渐移动到222 nm处的α-螺旋特征带。这种二级结构的重组不仅表明BMPP具有高度可塑性,还为其在实际应用中提供了良好的力学性能和稳定性基础。
综上所述,作者通过基因工程和分子设计,成功开发出一种新型的仿生融合蛋白,其结合了高拉伸强度、优良的延展性和特定的生物功能。这一设计为开发多功能、高性能的仿生材料提供了新思路,并展示了其在生物医学领域的广阔应用潜力。
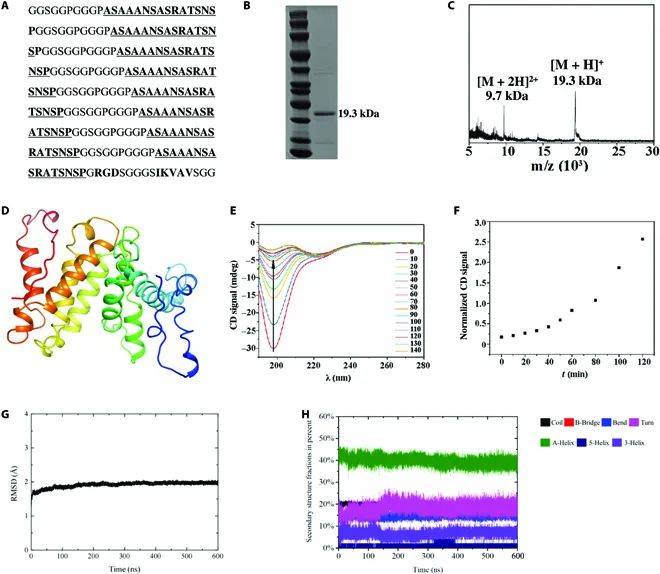
图1:仿生多肽的设计与结构验证
02 分子对接指示多肽的自组装过程
为了进一步揭示BMPP纳米原纤维形成的分子机制,作者采用蛋白质-蛋白质对接模拟,深入分析了特定界面结合在纳米原纤维自组装中的关键作用。
使用HDOCK对BMPP进行蛋白对接,生成了前10个对接模型,并选取对接能量得分最低的模型作为模板,用于构建由2至10个单体组成的复杂BMPP组装结构。
为了验证这些组装模型的动力学稳定性,研究团队对它们进行了分子动力学(MD)模拟,并采用MM/GBSA方法计算结合自由能,从热力学角度评估组装过程中各单体之间的结合亲和力。根据模拟结果,3个复杂模型在根均方偏差(RMSD)方面表现出良好的结构稳定性,显示出组装体在动态环境下能够保持一致的构象。
结合自由能的分析进一步说明了BMPP在自组装过程中的结合特性:
二阶组装的平均界面结合自由能为 −291.88 ± 8.37 kcal/mol,表现出较高的亲和力。
三阶、四阶、五阶和六阶组装的平均界面结合自由能分别为 −253.17 ± 7.75、−278.05 ± 8.55、−253.42 ± 8.11和 −251.49 ± 8.04 kcal/mol。
尽管组装复杂性增加,BMPP组装过程中界面结合自由能保持稳定,整体亲和力并未显著削弱。自组装动力学显示,纳米纤维形成经历成核、表面生长和稳定阶段。 到纤维长度可控,直径约10 nm,形态均一。
综上,研究通过蛋白-蛋白对接和分子模拟清晰展示了BMPP纳米原纤维自组装的分子机制。特定界面的稳定结合是组装过程的关键驱动力,而结合自由能的稳定性则确保了自组装体在动态条件下的结构完整性。
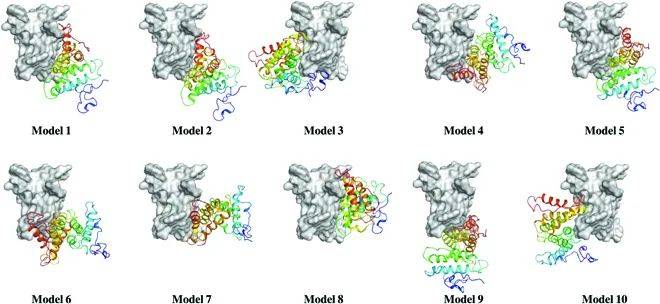
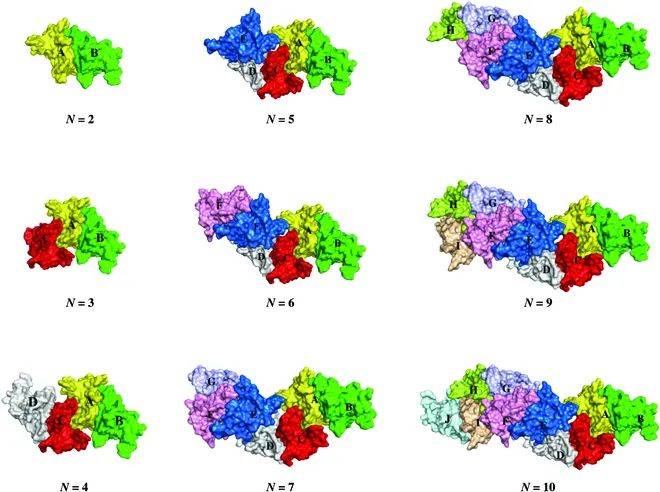
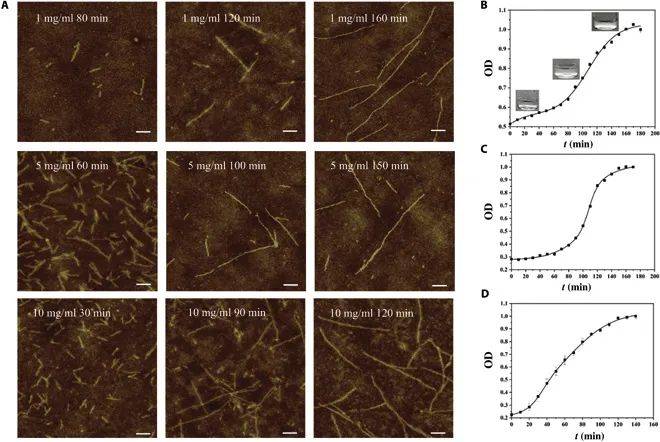
图2-4:仿生多肽纳米纤维的自组装机制
02 多肽免疫调节功能验证
为了进一步探索其免疫调节作用,作者研究了BMPPs对RAW264.7巨噬细胞极化的影响,尤其是炎性细胞因子的分泌和基因表达。
巨噬细胞的极化分为两种主要表型:M1型(促炎性)和M2型(抗炎性)。M1型巨噬细胞通过一氧化氮合酶2(NOS2)、白介素6(IL6)和肿瘤坏死因子α(TNFα)的表达表征,而M2型极化则通过精氨酸酶1(Arg1)和白介素10(IL10)的水平反映。
实验结果显示,高浓度的BMPPs(0.75 mg/ml和1.5 mg/ml)显著促进了M1型巨噬细胞的极化。此外,ELISA检测进一步验证了这一趋势。同时,M2型标志物Arg1的表达在BMPPs处理下被下调3-5倍。
通过这些实验,作者明确了BMPPs的免疫调节作用。高浓度BMPPs不仅能够显著增强M1型巨噬细胞的活化,还可以精准地调控巨噬细胞免疫应答的方向。特别是在1.5 mg/ml的浓度下,BMPPs展现了显著的免疫调节效果,能够准确触发M1型巨噬细胞的极化。这一功能为BMPP作为纳米免疫调节剂在炎症调控、免疫治疗以及相关生物医学领域中的应用奠定了重要基础。
作者指出,通过调节含有整合素相关基序(如RGD和IKVAV)的BMPP纳米免疫调节剂的丰度,可以有效调整巨噬细胞的行为。实验结果表明,BMPP纳米免疫调节剂在促进M1型巨噬细胞极化方面表现出精确的可调性,能够根据不同浓度引导细胞的免疫响应。这种能力使BMPP纳米免疫调节剂能够产生梯度式的免疫应答,从而显著扩展了免疫调节的操作剂量窗口,为免疫治疗提供了更大的灵活性。
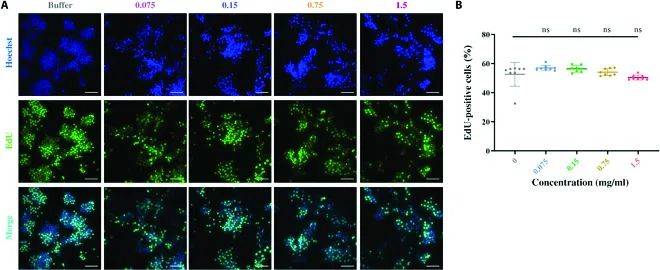

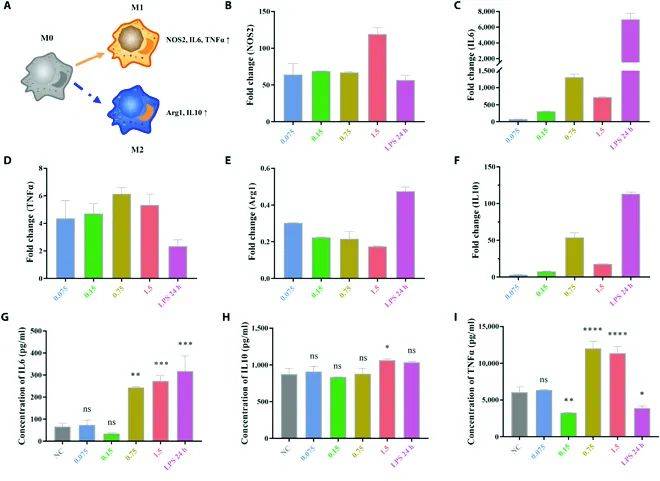
图5-7:仿生多肽诱导巨噬细胞极化为M1型
研究总结
本研究引入了一种全新设计的基于多肽的纳米纤维材料,能够精准重置巨噬细胞的极化方向。突出了BMPP纳米免疫调节剂的潜在价值,不仅为基础研究提供了新工具,还可能推动肿瘤免疫疗法的未来发展
值得注意的是,本研究通过分子对接高效指示纳米蛋白纤维材料的自组装过程,HDOCK+MD分子动力学模拟,量化结合能与蛋白图像从多层次深入了解机制。后续可以通过其他AI Model,结合转录组数据,继续探究材料的免疫调控机制。